发展高水平癌症治疗手段是医药领域的研究热点。光动力治疗(PDT)作为一种创伤小、定域化的治疗方式为癌症治疗提供了新的思路。在占据主导地位的光动力II型反应中,光照射光敏剂产生的单线态氧(1O2)是治疗主体,但肿瘤特殊的低氧环境限制着单线态氧的产率,而光源有限的穿透能力也制约着光动力治疗对深处肿瘤的杀伤效果。
重新诠释光动力治疗,体外产生单线态氧并将其递送于病灶将有效解决上述问题。单线态氧可以通过 [4+2] 环加成反应与蒽、吡啶酮或萘反应生成内过氧化物。内过氧化物在一定条件下可以发生逆环加成反应释放单线态氧,内过氧化物作为单线态氧载体为癌症治疗提供了全新思路。Akkaya院士在前期工作中,将BODIPY光敏剂和吡啶酮结合,构建了在光照和非光照下均可释放单线态氧的抗癌体系(Angew. Chem. Int. Ed., 2016, 55, 2875)。为解决单线态氧的控释问题,Akkaya院士开发了近红外光遥控(Angew. Chem. Int. Ed., 2016, 55, 3606)、外源性氟离子促发(Chem. Commun., 2019, 55, 13808)和肿瘤微环境响应的(Chem. Commun., 2020, 56, 14793)单线态氧控释机制,实现了单线态氧的精准调控和癌症治疗。
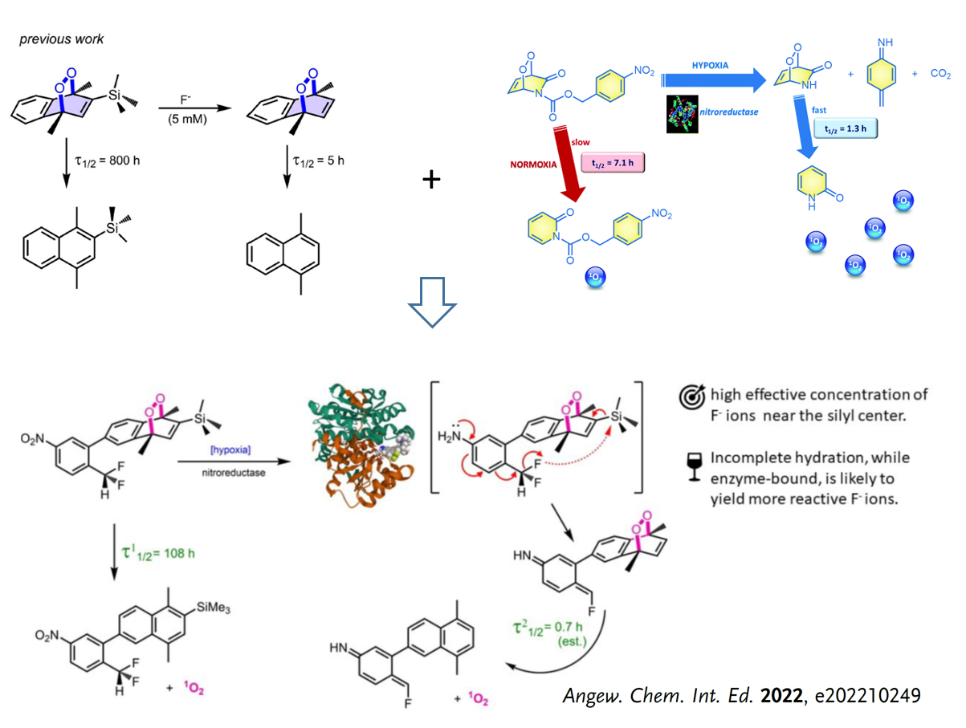
近日,精细化工国家重点实验室Akkaya院士团队在单线态氧的精准控释及应用取得了新的进展。通过将前期工作开发的外源性氟离子促发和肿瘤微环境响应的单线态氧控释机制有机结合,本项工作实现了无需外源性刺激参与的,萘类内过氧中单线态氧的精准调控。利用三甲基硅烷(TMS)构建稳定的萘类内过氧化物(单线态氧释放半衰期108小时,37 °C),引入氟源(二氟甲基)和肿瘤微环境响应单元(硝基),通过肿瘤过表达的硝基还原酶还原分子中的硝基,促发了氟离子的释放和分子内反应断裂TMS基团,进而活化内过氧化物(单线态氧释放半衰期小于1小时,37 °C),实现了单线态氧的快速、集中释放。细胞外/内单线态氧释放实验、细胞毒性实验和细胞凋亡结果均验证了这一新型单线态氧机制的精准性和高效性。本工作充分利用肿瘤微环境开发内过氧前药,实现了内过氧化物中单线态氧的精准控释,为乏氧肿瘤治疗提供了新思路并推动了智能分子设计和疾病治疗中的应用。
研究成果近日发表于Angew. Chem. Int. Ed.并被选为VIP和Frontispiece。文章第一作者为大连理工大学博士研究生吴浩,通讯作者为Akkaya院士和王磊副教授。该项目得到了国家自然科学基金和辽宁省“兴辽英才计划”项目的支持。
文章链接:https://doi.org/10.1002/ange.202210249