北京时间2021年11月4日,大连理工大学精细化工国家重点实验室彭孝军院士、樊江莉教授团队在Chem(Cell子刊,IF: 22.804)上发表一篇题为“The concept and examples of type III photosensitizers for cancer photodynamic therapy”的研究论文。
课题组构建了新型具有type III机制的光敏剂,实现将光能直接用于破坏肿瘤细胞内的RNA,以达到杀伤肿瘤细胞的效果。治疗过程无需媒介参与,突破了当前肿瘤光动力治疗过程中依赖氧气的桎梏。该光敏剂用于光动力治疗肿瘤的同时,能够提升机体的免疫反应,对于实体肿瘤和转移肿瘤均具有优异的治疗效果。
彭孝军院士和樊江莉教授为本论文的通讯作者,姚起超博士为第一作者,大连理工大学为唯一通讯单位。
光动力疗法(PDT)是一种非侵入性治疗方式,在个性化医疗中获得了巨大的普及。与传统的化疗、放疗和手术相比,PDT具有微创、不受耐药性影响、治疗区域选择可控等优点。目前,PDT通过可见光照射激活光敏剂,在氧气存在下产生具有细胞毒性的活性氧物种(I型和II型机制,图一),杀伤过程依赖氧气。虽然I型光敏剂可以通过氧气的部分循环减轻PDT过程对氧的依赖,但光敏化过程仍需要氧气来维持。然而,实体肿瘤所处的微环境往往是缺氧环境,这极大影响了PDT过程中光敏药物对肿瘤细胞的杀伤作用。
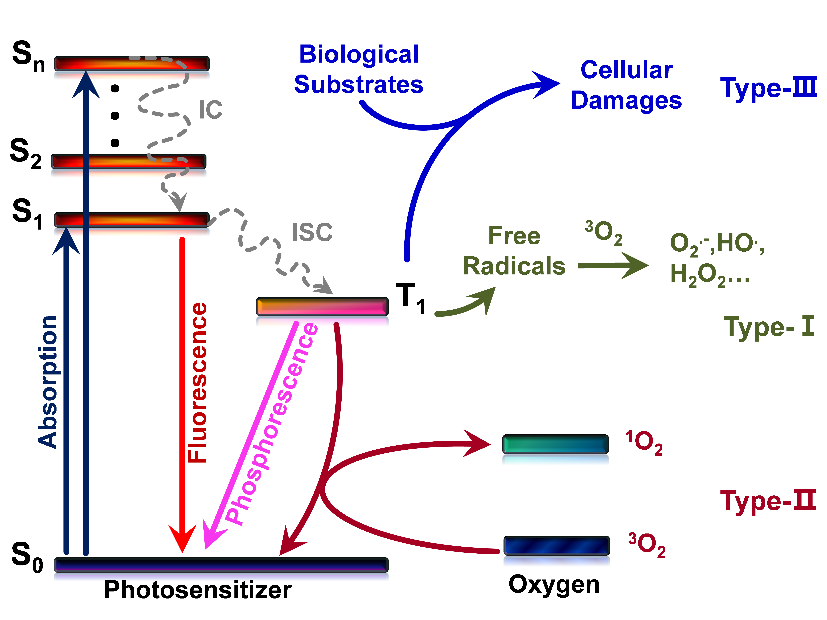
图一 PDT中三种机理示意图
彭孝军院士、樊江莉教授受团队前期工作的启发,开发了一系列具有type III机制(图一)的新型光敏剂NBEX(X = S,Se,Te)。该类光敏剂能够精准识别RNA,在激发光照射下能够直接将激发能或电子传递给RNA,通过破坏RNA以达到灭杀肿瘤细胞的功效(图二)。该PDT过程无需氧气作为媒介,在低氧甚至无氧的条件下,NBEX亦可有效灭杀肿瘤细胞(图三)。
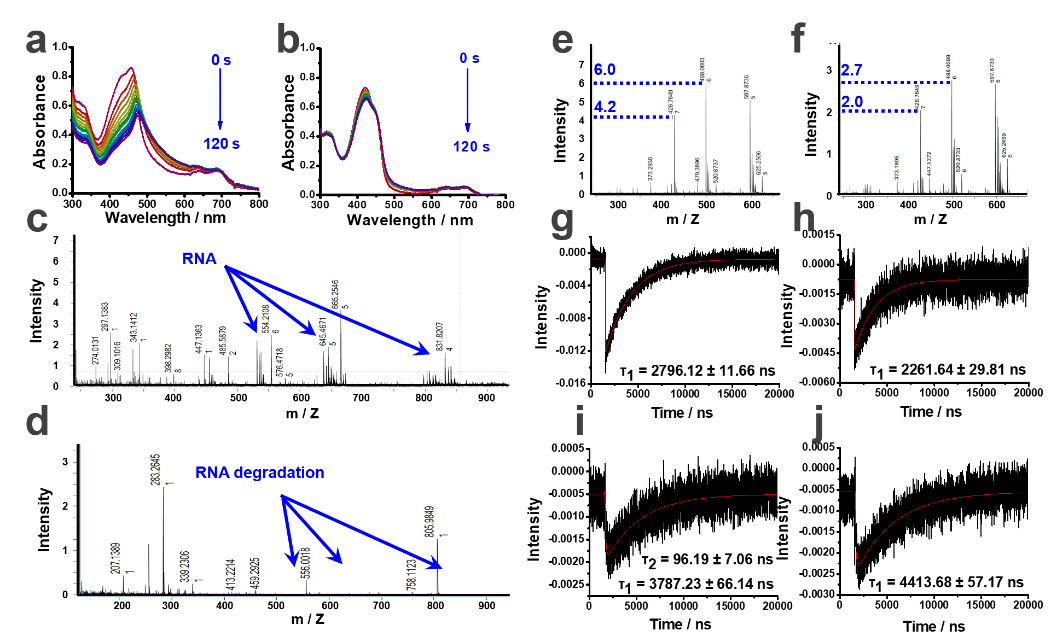
图二 type III机制的验证
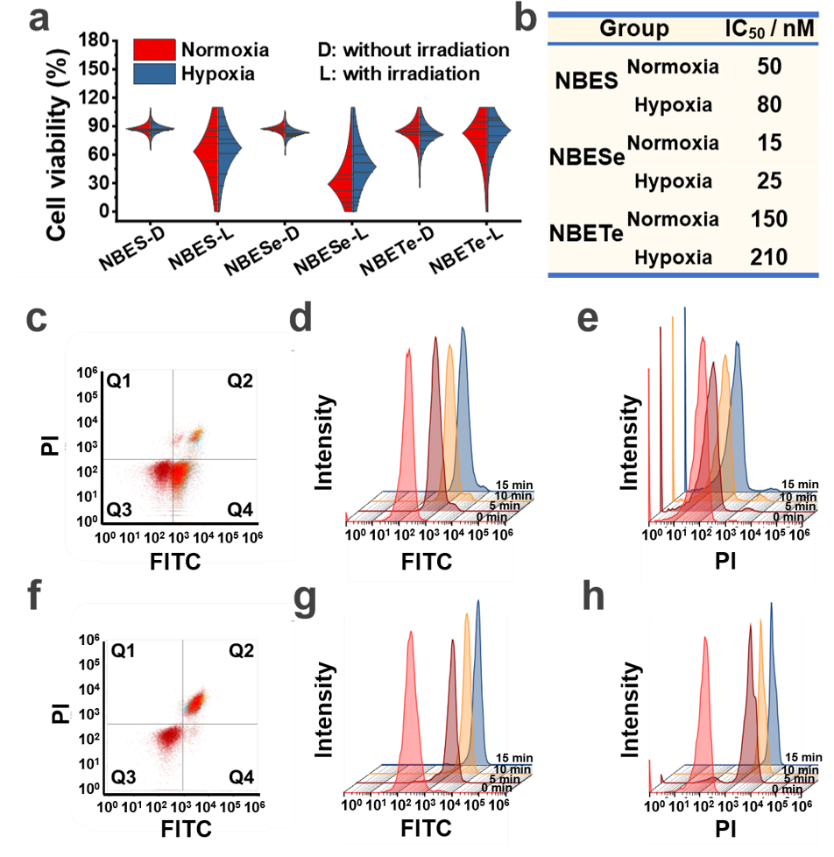
图三 常氧/低氧下NBEX的细胞毒性及流式细胞术检测细胞死亡方式
研究还发现,在水溶液中NBEX自聚集形成纳米粒子,该溶液经尾静脉注射到荷瘤小鼠体内后,能够快速富集到肿瘤区域。给药后,小鼠肿瘤区域经近红光照射治疗后,3天后实验组光照区肿瘤部位开始溃烂;5天后部分肿瘤脱落并形成痂。治疗一段时间后,相较于对照组,治疗组小鼠的肿瘤不但显示出了明显的抑制效果而且未见明显肿瘤转移。同时,对实验小鼠进行免疫分析的结果显示治疗组中小鼠的成熟树突细胞(DC)的含量明显高于对照组,这意味着治疗组的免疫激活率较高。这些实验结果表明,使用NBEX作为光敏剂的PDT不仅可以有效治疗实体瘤,抑制肿瘤转移,还可以在一定程度上诱导DC成熟,并且可能作为肿瘤疫苗来促进免疫应答。(图四)
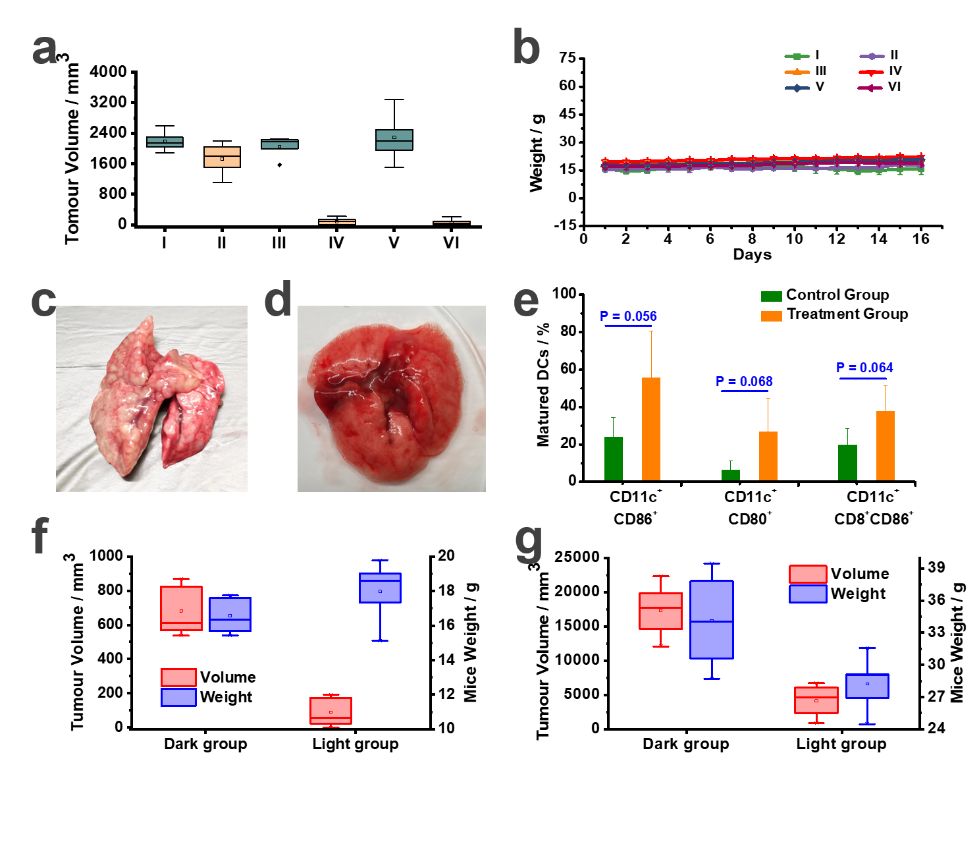
图四 NBEX对肿瘤的治疗作用及小鼠免疫分析结果
综上所述,该研究构建了一系列具有type III光敏机制的光敏剂NBEX。NBEX能在体内迅速富集到肿瘤部位,并进入肿瘤细胞与RNA结合。经光照射后,NBEX能够将激发能直接传递给RNA分子从而灭杀肿瘤细胞。该过程中不需要氧气参与,在常氧和低氧条件下对肿瘤细胞均具优异的杀伤作用。NBEX对多种肿瘤均展现出优异的杀伤性能,并抑制肿瘤细胞转移。PDT的同时增强机体对肿瘤的免疫反应,这对于预防肿瘤复发以及肿瘤治疗都非常重要。
该研究论文得到了国家自然科学基金、国家自然科学基金-辽宁省联合基金、中国博士后科学基金、大连理工大学和精细化工国家重点实验室的大力支持。
相关论文信息:https://doi.org/10.1016/j.chempr.2021.10.006