癌症是一类严重危害人类生命健康的疾病。我国每年新发癌症病例超过350万,死亡病例超过200万。由于传统外科手术治疗后患者还要承受化疗、放疗的痛苦,因此探寻新型精准有效治疗癌症手段具有重大意义。光动力学疗法(Photodynamic therapy, PDT)是用光敏药物和激光活化治疗肿瘤疾病的一种新方法,其原理是利用光敏材料在特定光激发下产生的活性氧物种杀死癌细胞,具有“光到病除”等优点。与使用毒性光源的放疗和使用细胞毒药物的化疗不同,光动力疗法中光敏剂分子是无毒且良性的,消灭癌细胞时并不会损伤正常细胞。但是由于单线态氧寿命短(0.04-3 μs),扩散距离有限(0.01-0.155 μm),因而其光动力治疗效果通常不够理想。如何通过分子空间构型设计,使其与生物体内关键物质,如DNA直接的接触,是提升其PDT效果的重要科学问题之一。
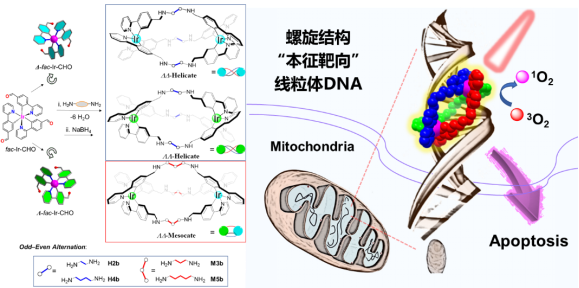
近日,精细化工国家重点实验室段春迎教授团队首次开发双核Ir(III)三螺旋超分子组装体光动力治疗试剂用于相关癌症的高效治疗。从晶体学工程出发,首先预合成修饰有醛基的fac-Ir(ppy)3构筑块,进一步与具有不同长度的线型二胺分子进行缩合,利用二胺连接体的偶奇效应,可控获得具有不同长度和立体构型的双核Ir(III)金属-有机三螺旋结构。进一步将亚胺基团还原成氨基,得到系列光稳定性好的三螺旋结构。该类螺旋结构具有非常优异的磷光发射能力(ΦPL: 93.5% ~ 99.3%)和单线态氧生成效率(Φs: 30% ~ 33%)。作者系统研究三螺旋结构的空间立体构型、螺旋链的长度对癌细胞中线粒体DNA绑定作用的影响。分子对接模拟计算结果表明,具有特定长度的非手性螺旋结构能够嵌入DNA分子小沟槽内部,表现出更强的绑定作用。用30毫瓦每平方厘米的白光照射10分种便可杀死97%以上的癌细胞,显示出优异的光动力癌症治疗效果。这种无需额外引入靶向基团,利用螺旋结构本征靶向DNA分子的特性,使开发此类光动力治疗试剂具有很大的实际应用前景。相关成果近期发表在Angew. Chem. Int. Ed., 2020, 59, 6420-6427上。文章第一作者为大连理工大学博士后李学召和博士生吴金国,通讯作者为何成教授和段春迎教授。该工作得到了国家自然科学基金青年项目、NSFC-辽宁联合基金重点项目,中荷国际交流项目和大连理工大学的大力支持。