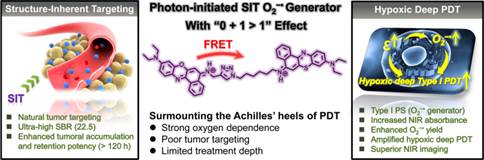
光动力治疗(Photodynamic Therapy, PDT)作为一种有别于传统癌症治疗手段(手术、放疗、化疗等)的新型光介导治疗方式,凭借其优异的物理靶向性,良好的可重复应用无耐药性、以及创伤小等优点,日渐成为一种颇具前景的肿瘤治疗手段。光动力治疗过程中,光敏剂可在特定波长激发光的作用下产生活性氧类物质(reactive oxygenspecies, ROS),导致肿瘤细胞坏死和凋亡,或通过破坏肿瘤组织中的微血管造成局部缺血缺氧导致癌细胞死亡。然而,传统光敏剂普遍具有高氧依赖性、肿瘤靶向性差、治疗深度有限等缺点,这严重限制了PDT在临床中的广泛应用。针对肿瘤乏氧问题,团队成员之前开发了首例近红外光控小分子超氧阴离子自由基产生体(O2−•,),成功应用于荷瘤小鼠厌氧实体瘤模型光动力治疗,并揭示了O2−•在严重低氧环境下(2% O2)仍具有抗癌活性的潜在机制(J. Am. Chem. Soc.2018, 140, 14851−14859)。另一方面,团队提出了利用福斯特共振能量转移机制引入罗丹明阳离子的方式,构建光敏剂自发靶向肿瘤部位,并提出了“结构固有靶向诊疗敏化剂”的概念(J. Am. Chem. Soc.,2018, 140, 15820-15826),为肿瘤的靶向治疗提供了新思路。然而,这些方法对于实体瘤内部治疗效果依然有限。
彭孝军教授团队提出了一种新颖的策略,即利用光子引发的具有0 + 1 > 1放大效应的双阳离子过氧化物自由基(O2−•)发生器(ENBOS)来同时克服光动力治疗过程上述三个缺点,实现了靶向厌氧实体瘤深度治疗。研究利用福斯特共振能量转移理论、能量供体成功增强了ENBOS近红外吸收和光子效用,进而导致ENBOS更容易在深层组织被激活并产生更多的O2−•,因此大大提高PDT对深部乏氧实体瘤的治疗效果。此外,由于双阳离子性质,ENBOS具有优异的“结构固有靶向”特性,可自发在肿瘤部位聚集,静脉注射48 h后信号背景比高达25.2,为精确成像指导的肿瘤治疗提供了良好的基础。同时,ENBOS的瘤内积累和保留性能也显著提高(> 120 h)。基于这些独特的性能,ENBOS在低光剂量照射下可以高效地抑制肿瘤生长。这些实验和理论结果将有助于设计开发高效光敏剂,应用于临床乏氧实体瘤的靶向诊断与治疗。
相关成果发表于J. Am. Chem. Soc. 2019, 141, 2695−2702。文章第一作者是本课题组博士研究生李明乐,通讯作者为大连理工大学彭孝军教授,以上工作得到了国家自然科学基金、NSFC-辽宁联合基金的大力支持。