光动力治疗(PDT)作为一种新兴的恶性肿瘤的治疗方式,其基本原理为光敏剂将吸收的光能转化为活性氧(ROS)以诱导细胞凋亡和组织损伤。根据不同的光化学反应过程,PDT分为两种作用机制:I型和II型。II型PDT主要基于产生高毒性的单线态氧(1O2)杀死肿瘤细胞,在目前的光动力治疗中占主导地位。然而,II型PDT高度依赖于肿瘤部位的氧气浓度,这与肿瘤缺氧的固有性质相冲突,因而治疗效果不尽如人意。与II型机制中激发态光敏剂直接将能量转移给O2不同,I型过程是通过激发态光敏剂将电子或氢质子转移到周围的基质,从而产生自由基物种(例如,超氧阴离子(O2−•)和羟基(OH•)自由基)。其中,过量的O2−•能够与蛋白质,DNA和脂质反应,对细胞造成不可逆转的损害。重要的是,O2−•还可参与超氧化物歧化酶(SOD)介导的歧化反应,从而实现O2的再利用并引发其他剧毒活性氧物种的生成,可以有效缓解乏氧限制。然而,在I型光敏剂的设计上,很少有简便且通用的策略。
精细化工国家重点实验室彭孝军院士研究团队宋锋玲教授课题组致力于具有延迟荧光性质的荧光素衍生物(II型光敏剂)的开发及其在肿瘤的光动力治疗中的应用。近日,他们将具有肿瘤靶向性的生物素单元共价修饰到II型光敏剂(两种为荧光素衍生物,一种为商品化原卟啉)中,开发了三种兼具I型和II型机制的有机小分子光敏剂,有效缓解了光动力治疗对氧气的高度依赖性(图1)。研究发现,生物素单元的引入不仅赋予了光敏剂肿瘤靶向能力,而且在不影响单线态氧的生成的前提下,生物素化还激活或增强了这三种光敏剂的O2−•生成能力。在对生物素化效应的机理进行研究时发现,生物素可以以分子内的方式充当富电子底物,且化合物1的折叠构象有利于生物素部分和PS部分之间发生更有效的电子转移,从而促进I型PDT机制的发生(图2)。考虑到这三种光敏剂的结构和光物理性质的不同,生物素化可被视为将II型光敏剂改造成I/II组合型光敏剂的通用型设计策略,且这种光敏剂可同时具有肿瘤靶向和耐缺氧的性能。
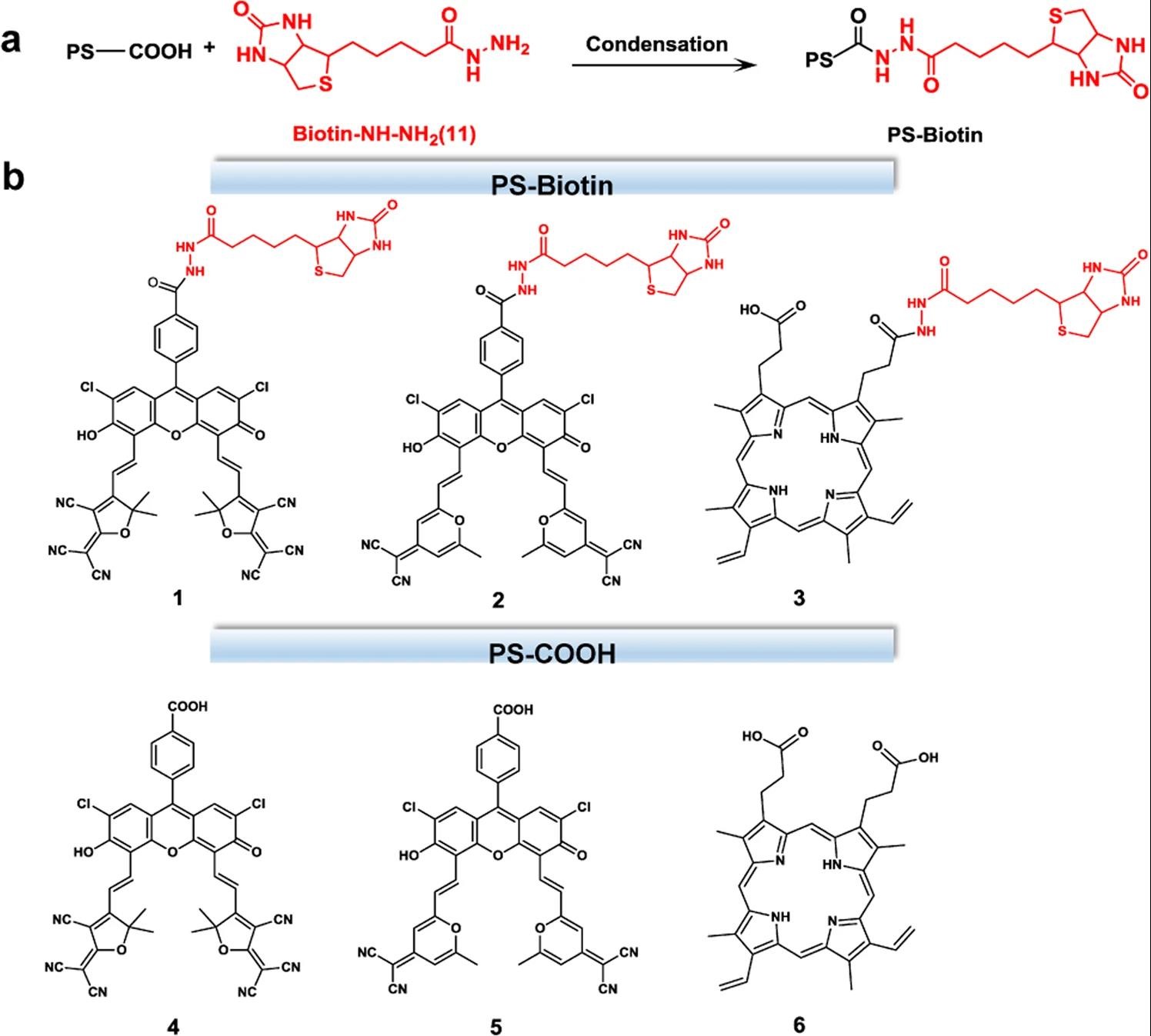
图1 (a)光敏剂生物素化策略。(b)化合物1-6的化学结构。
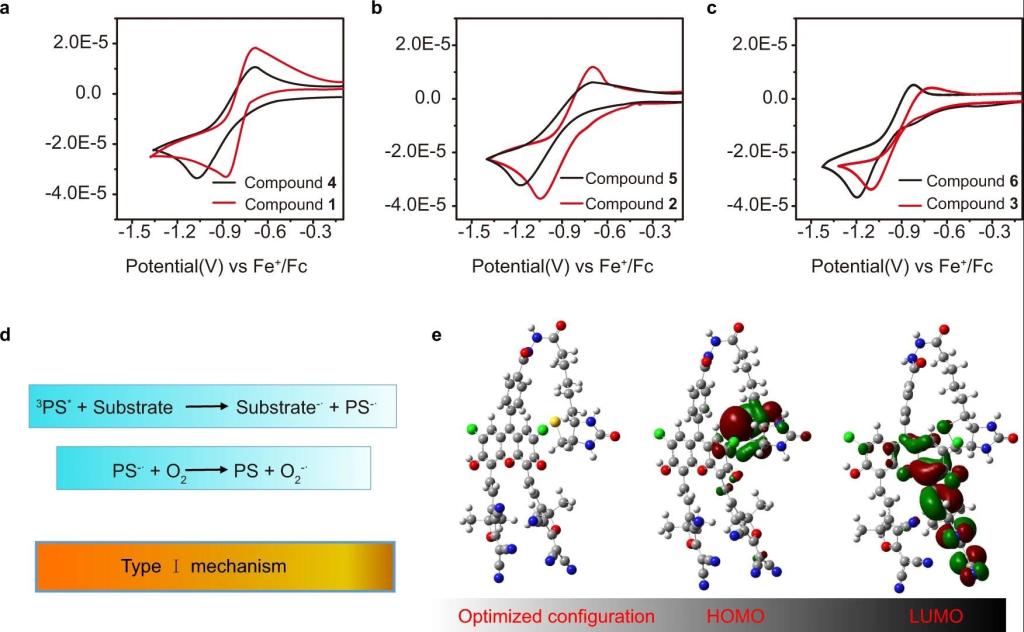
图2 生物素化效应的机理解释。
该研究成果以Research Article形式发表在国际学术期刊Nature Communications 上。大连理工大学博士研究生安静为文章的第一作者,宋锋玲教授和辽宁省肿瘤医院介入科主任郑文恒教授为文章的通讯作者。
论文信息:
https://www.nature.com/articles/s41467-022-29862-9
An unexpected strategy to alleviate hypoxia limitation of photodynamic therapy by biotinylation of photosensitizers
Jing An, Shanliang Tang, Gaobo Hong, Wenlong Chen, Miaomiao Chen, Jitao Song, Zhiliang Li, Xiaojun Peng, Fengling Song & Wen-Heng Zheng
Nat. Commun., 2022, 13, 2225, DOI: 10.1038/s41467-022-29862-9